(时间:90分钟 满分:100分)
一、选择题(本题包括15个小题,每小题3分,共45分。每小题仅有一个选项符合题意)
1.H2与O2发生反应的过程可用模型图表示如下(“—”表示化学键),下列说法不正确的是( )
![]()
A.过程Ⅰ是吸热过程
B.过程Ⅲ一定是放热过程
C.该反应过程所有旧化学键都断裂,且形成了新化学键
D.该反应的能量转化形式只能以热能的形式进行
答案:D
2.下列有关化学反应速率和化学平衡的叙述中正确的是( )
A.催化剂和温度是决定化学反应速率的主要因素
B.实验室常用加热的方式来加快化学反应的速率
C.家庭利用冰箱使原本容易变质的食物不再变质
D.N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
2NH3(g) ΔH<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
答案:B
3.25℃、101 kPa时,1 g甲醇完全燃烧生成CO2和液态H2O,同时放出22.68 kJ热量。下列表示该反应的热化学方程式中正确的是( )
A.CH3OH(l)+3/2O2(g)===CO2(g) +2H2O(l)
ΔH=-725.8 kJ·mol-1
B.2 CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)
ΔH=+1 451.6 kJ·mol-1
C.2 CH3OH+O2===2CO2+4H2O
ΔH=-22.68 kJ·mol-1
D.CH3OH(l)+3/2O2(g)===CO2(g)+2H2O(g)
ΔH=-725.8 kJ·mol-1
答案:A
4.为减轻温室效应,科学家已致力于研究CO2的捕捉与封存技术,其反应原理之一为:CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g) ΔH<0,下列措施既能加快反应速率又能提高产率的是( )
CO(NH2)2(s)+H2O(g) ΔH<0,下列措施既能加快反应速率又能提高产率的是( )
A.升高温度 B.分离出CO(NH2)2
C.缩小容器体积 D.使用催化剂
答案:C
5.一定条件下,在密闭恒容的容器中,发生如下反应:3A(g)+2B(g)+6C(g)
![]() M(s)+12N(g),不能表示上述反应达到化学平衡状态的是( )
M(s)+12N(g),不能表示上述反应达到化学平衡状态的是( )
A.3v逆(B)=v正(C)
B.容器内压强不再改变
C.混合气体密度保持不变
D.c(B)∶c(C)∶c(N)=1∶3∶6
答案:D
6.已知热化学方程式(Q1,Q2均为正值):C(s)+O2(g)===CO(g) ΔH=-Q1 kJ·mol-1,C(s)+O2(g)===CO2(g) ΔH=-Q2 kJ·mol-1,有关上述反应的叙述错误的是( )
A.Q1<Q2
B.生成物总能量均高于反应物总能量
C.由1 mol C反应生成1 mol CO气体时放出Q1 kJ热量
D.1 mol CO2气体具有的能量大于1 mol干冰具有的能量
答案:B
7.为了探索外界条件对反应aX(g)+bY(g)![]() cZ(g)的影响,以X和Y物质的量比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。以下判断正确的是( )
cZ(g)的影响,以X和Y物质的量比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。以下判断正确的是( )
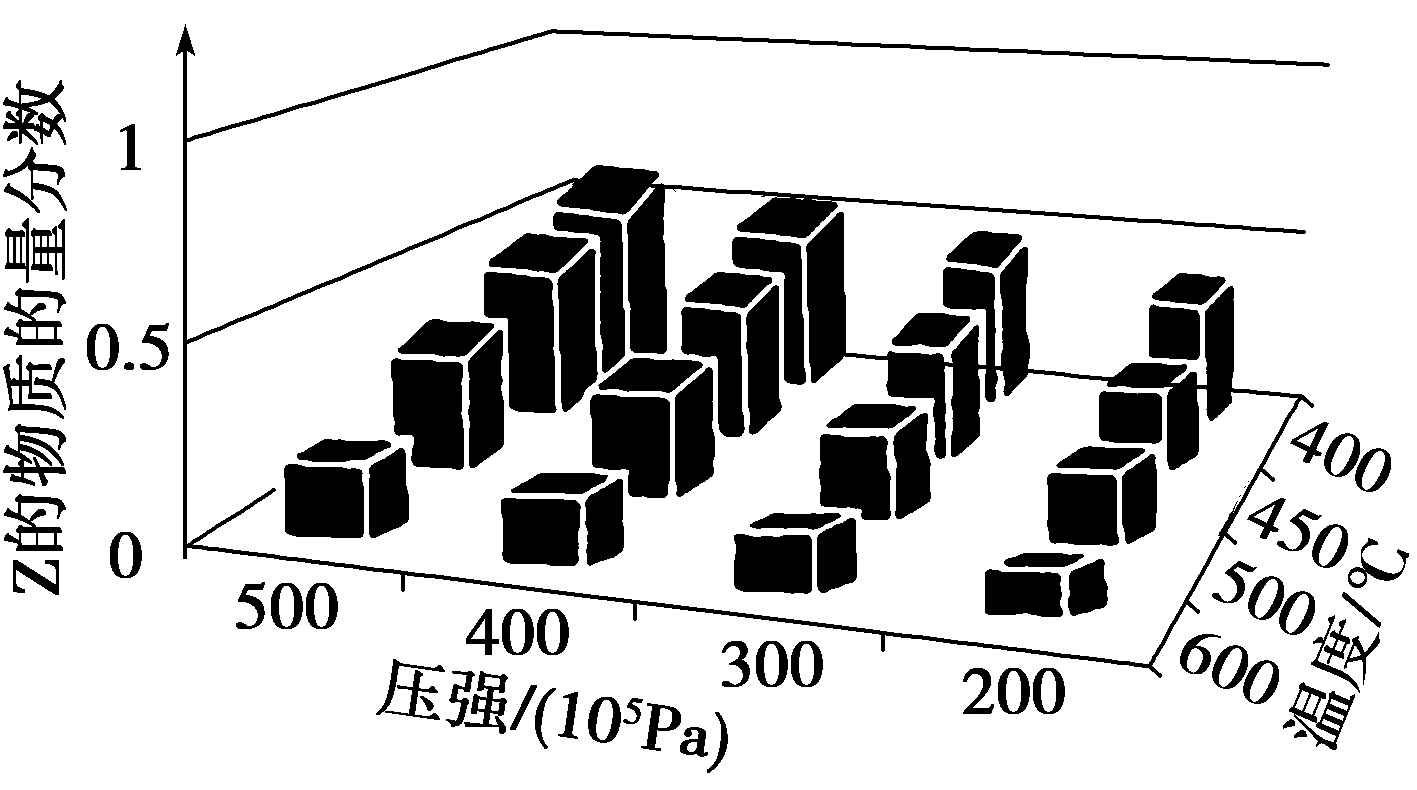
A.ΔH>0,a+b>c B.ΔH>0,a+b<c
C.ΔH<0,a+b>c D.ΔH<0,a+b<c
答案:C
8.向某恒容密闭容器
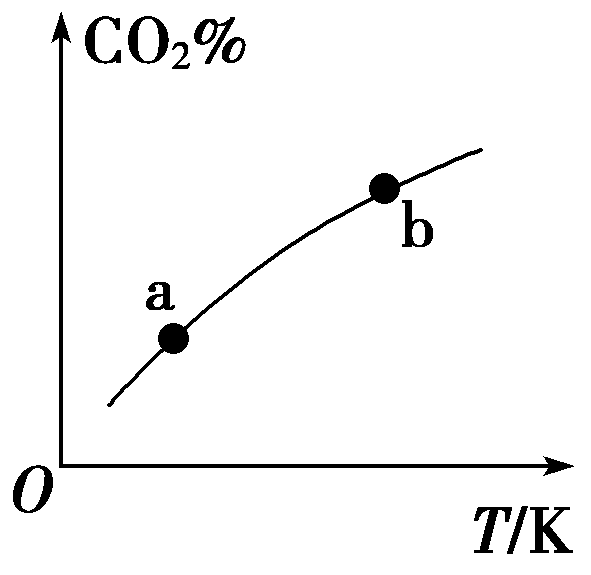
中充入一定量CO2和H2,发生反应:CO2(g)+H2(g)![]() HCOOH(g),测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示,下列物理量中,a点大于b点的是( )
HCOOH(g),测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示,下列物理量中,a点大于b点的是( )
A.正反应速率 B.逆反应速率
C.HCOOH(g)的浓度 D.H2的体积分数
答案:C
9.肼可作为火箭发动机的燃料,与氧化剂N2H4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)===N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(1)+O2(g)===N2(g)+2H2O(g) ΔH2= -534.2 kJ·mol-1
则反应2N2H4(l)+N2O4(l)===3N2(g)+4H2O(g)的ΔH为( )
A.-524.45 kJ·mol-1
B.-1 048.9 kJ·mol-1
C.+1 048.9 kJ·mol-1
D.+524.45 kJ·mol-1
答案:B
10.反应X(g)+Y(g)![]() 2Z(g) ΔH<0,达到平衡时,下列说法正确的是( )
2Z(g) ΔH<0,达到平衡时,下列说法正确的是( )
A.减小容器体积,平衡向右移动
B.加入催化剂,Z的产率增大
C.增大c(X),X的转化率增大
D.降低温度,Y的转化率增大
答案:D
11.在恒容容器中充入一定量的SO2和Cl2,发生反应SO2(g)+Cl2(g)![]() SO2Cl2
(g),测得体系中产物的百分含量与反应温度的变化如图所示,下列说法正确的是( )
SO2Cl2
(g),测得体系中产物的百分含量与反应温度的变化如图所示,下列说法正确的是( )
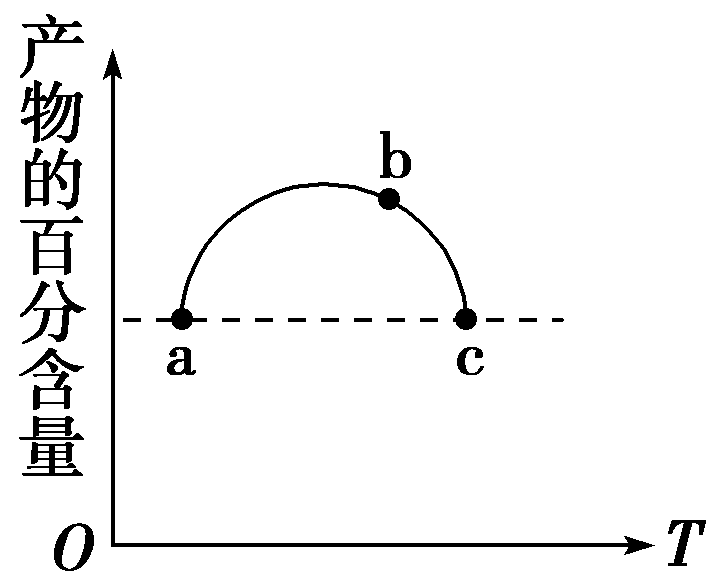
A.a、b、c三点均为平衡点
B.a、c两点的反应速率相同
C.b点对应温度的平衡常数大于c点对应温度的平衡常数
D.a、c两点体系的压强相同
答案:C
12.用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应4HCl(g)+O2(g)
![]() 2Cl2
(g)+2H2O(g),可实现氯的循环利用。已知4
mol HCl被氧化可放出115.6
kJ的热量。下列说法正确的是( )
2Cl2
(g)+2H2O(g),可实现氯的循环利用。已知4
mol HCl被氧化可放出115.6
kJ的热量。下列说法正确的是( )
A.该反应的热化学方程式是4HCl(g)+O2(g)
![]() 2Cl2
(g)+2H2O ΔH=-115.6
kJ·mol-1
2Cl2
(g)+2H2O ΔH=-115.6
kJ·mol-1
B.将36.5 g HCl(g)和8 g O2(g)充入一密闭容器中发生反应,反应放热28.9 kJ
C.加入催化剂,该化学反应的反应热改变
D.在温度、体积一定的条件下,通入4 mol HCl和1 mol O2反应后放出的热量为Q1 kJ,若通入8 mol HCl和2 mol O2反应后放出的热量为Q2 kJ,则231.2>Q2>2Q1
答案:D
13.在一定条件下,容器内某一反应M、N的物质的量随反应时间变化的曲线如下图所示,下列表述中正确的是( )
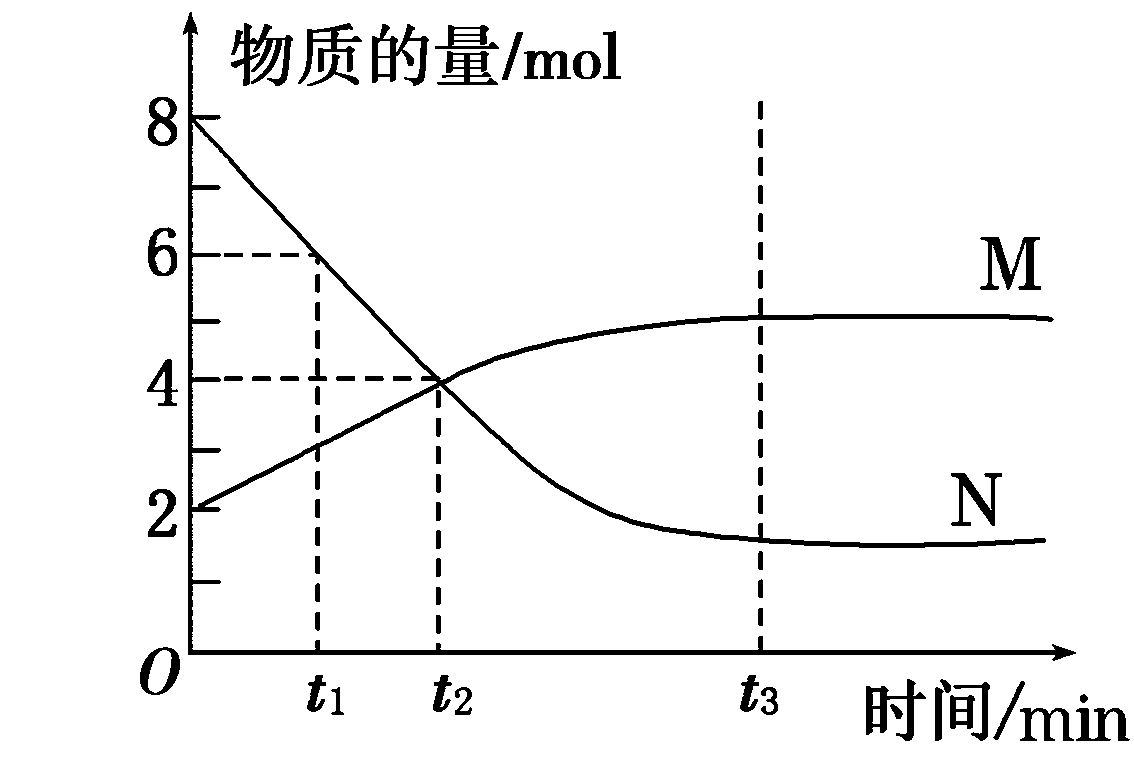
A.反应的化学方程式为2M![]() N
N
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M的浓度的2倍
答案:D
14.反应A(g)+2B(g)![]() C(g)+D(g) ΔH
=-Q
kJ·mol-1(Q>0)过程中的能量变化如图所示,有关叙述正确的是( )
C(g)+D(g) ΔH
=-Q
kJ·mol-1(Q>0)过程中的能量变化如图所示,有关叙述正确的是( )
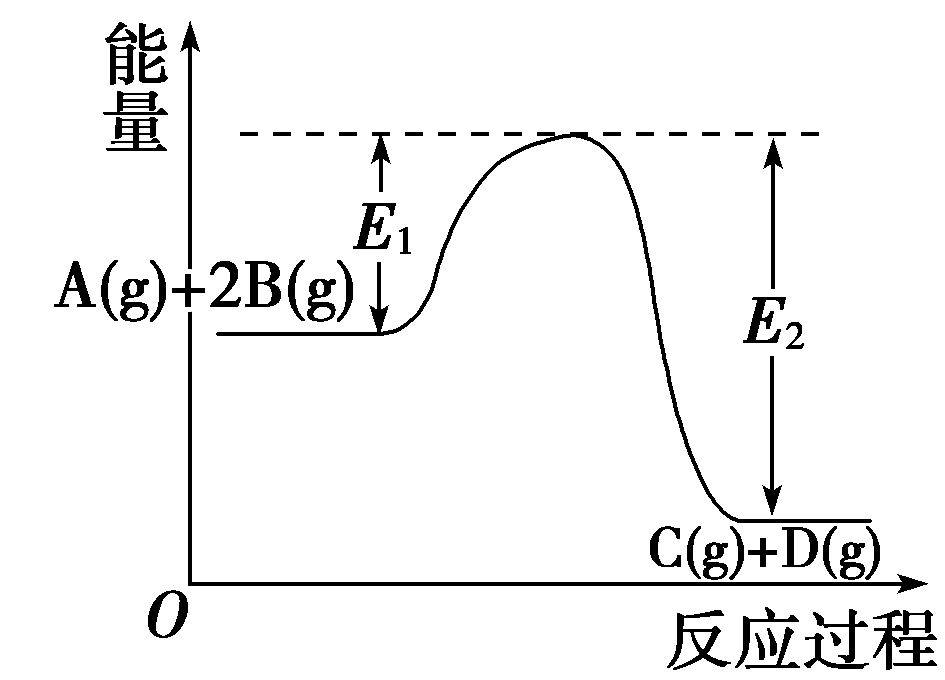
A.1 mol A(g)和2 mol B(g)具有的能量比1 mol C(g)和1 mol D(g)具有的能量低
B.在反应体系中加入催化剂,反应速率增大,E1减小,E2不变
C.Q=E2—E1
D.一定温度下,向密闭容器中充入1 mol A和2 mol B,充分反应后,放出Q kJ的热量
答案:C
15.可逆反应mA(g)+nB(s)![]() rC(g)+qD(g)在反应过程中,其他条件不变,D的体积百分含量和温度T或压强P的关系如图所示,下列叙述中正确的是( )
rC(g)+qD(g)在反应过程中,其他条件不变,D的体积百分含量和温度T或压强P的关系如图所示,下列叙述中正确的是( )
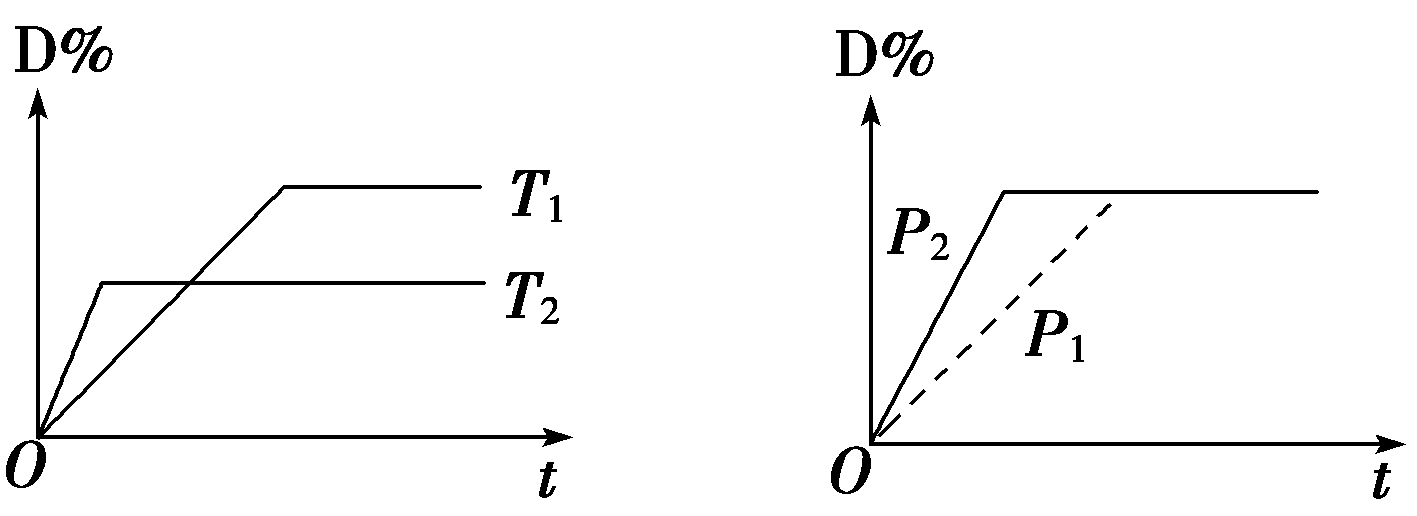
A.化学方程式系数m+n = r+q
B.使用催化剂,D的物质的量分数增加
C.温度降低,化学平衡向正反应方向移动
D.物质B的颗粒越小,反应越快,有利于平衡向正反应方向移动
答案:C
二、非选择题(本题包括5个小题,共55分)
16.(10分)金刚石和石墨均为碳的同素异形体,它们燃烧时,氧气不足生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示。
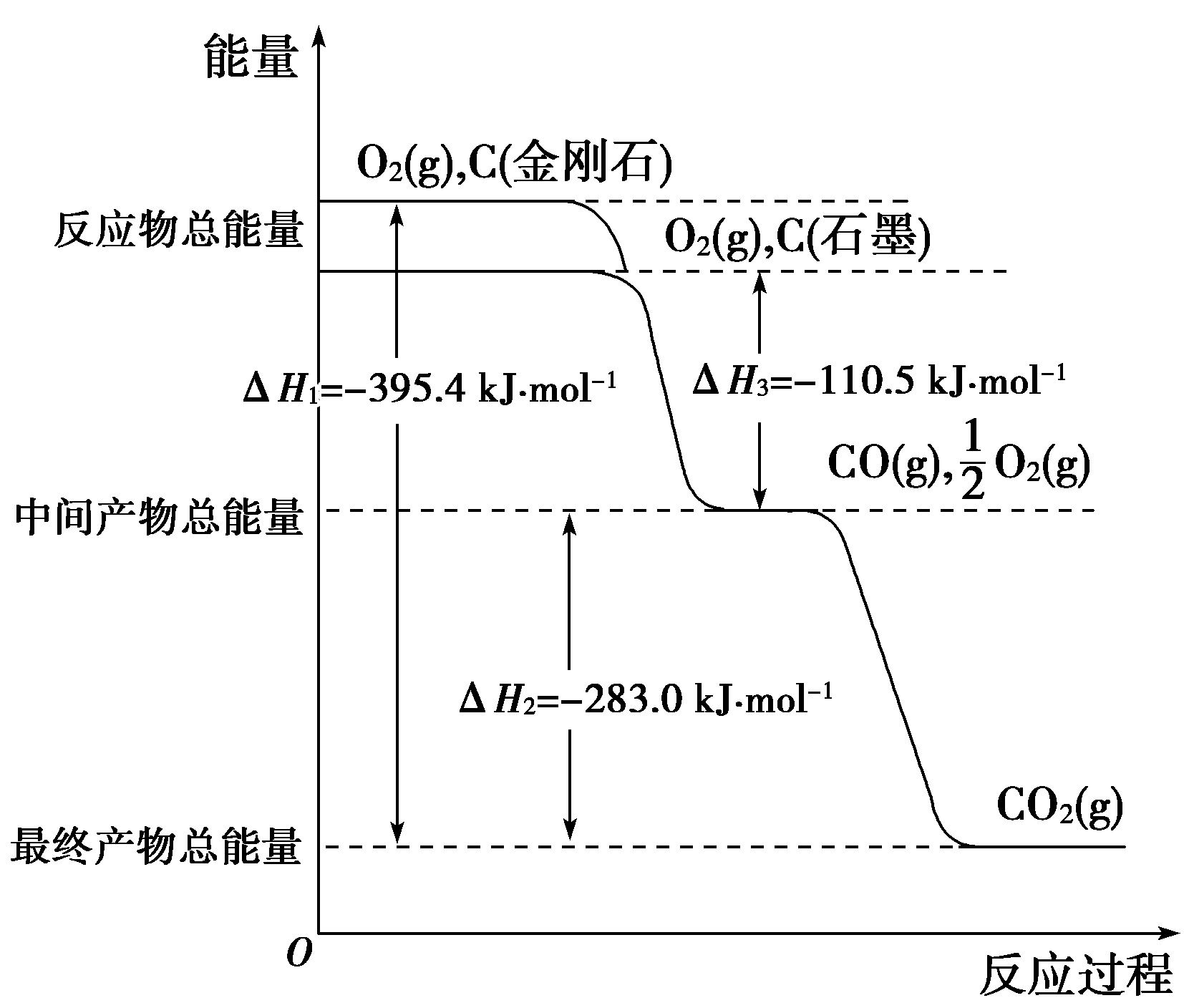
(1)等量金刚石和石墨完全燃烧________(填“金刚石”或“石墨”)放出热量更多,写出表示石墨燃烧热的热化学方程式________。
(2)在通常状况下,金刚石和石墨________(填“金刚石”或“石墨”)更稳定,写出石墨转化为金刚石的热化学方程式____________。
(3)12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出的热量为________。
解析:(1)从图象上很显然可以看出金刚石的能量比石墨高,所以等量金刚石和石墨完全燃烧金刚石放出的热量更多,根据燃烧热定义,石墨完全燃烧生成二氧化碳,根据图象反应放出的总热量为110.5 kJ+283.0 kJ=393.5 kJ,所以表示石墨燃烧热的热化学方程式为C(石墨,s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1 。
(2)因为金刚石能量比石墨高,根据能量越低越稳定可知在通常状况下石墨更稳定。石墨转化为金刚石要吸收热量,1 mol石墨转化为金刚石吸收热量395.4 kJ-393.5 kJ=1.9 kJ,热化学方程式为C(石墨,s)===C(金刚石,s) ΔH=+1.9 kJ·mol-1 。
(3)12 g石墨在一定量空气中燃烧,生成气体36 g,根据碳原子守恒,气体总物质的量为1 mol,所以生成气体的平均摩尔质量为36 g·mol-1,说明产物是CO和CO2的混合气体。可算出混合气体中CO和CO2的物质的量的比为1∶1,所以混合气体中CO和CO2各0.5 mol,该过程放出热量为(110.5 kJ +393.5 kJ)/2 =252.0 kJ。
答案:(1)金刚石 C(石墨,s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1 (2)石墨 C(石墨,s)===C(金刚石,s) ΔH=+1.9 kJ·mol-1 (3)252.0 kJ
17.(10分)催化剂在生产和科技领域起到重大作用。为比较Fe3+、Cu2+和MnO2对H2O2分解反应的催化效果,某化学小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
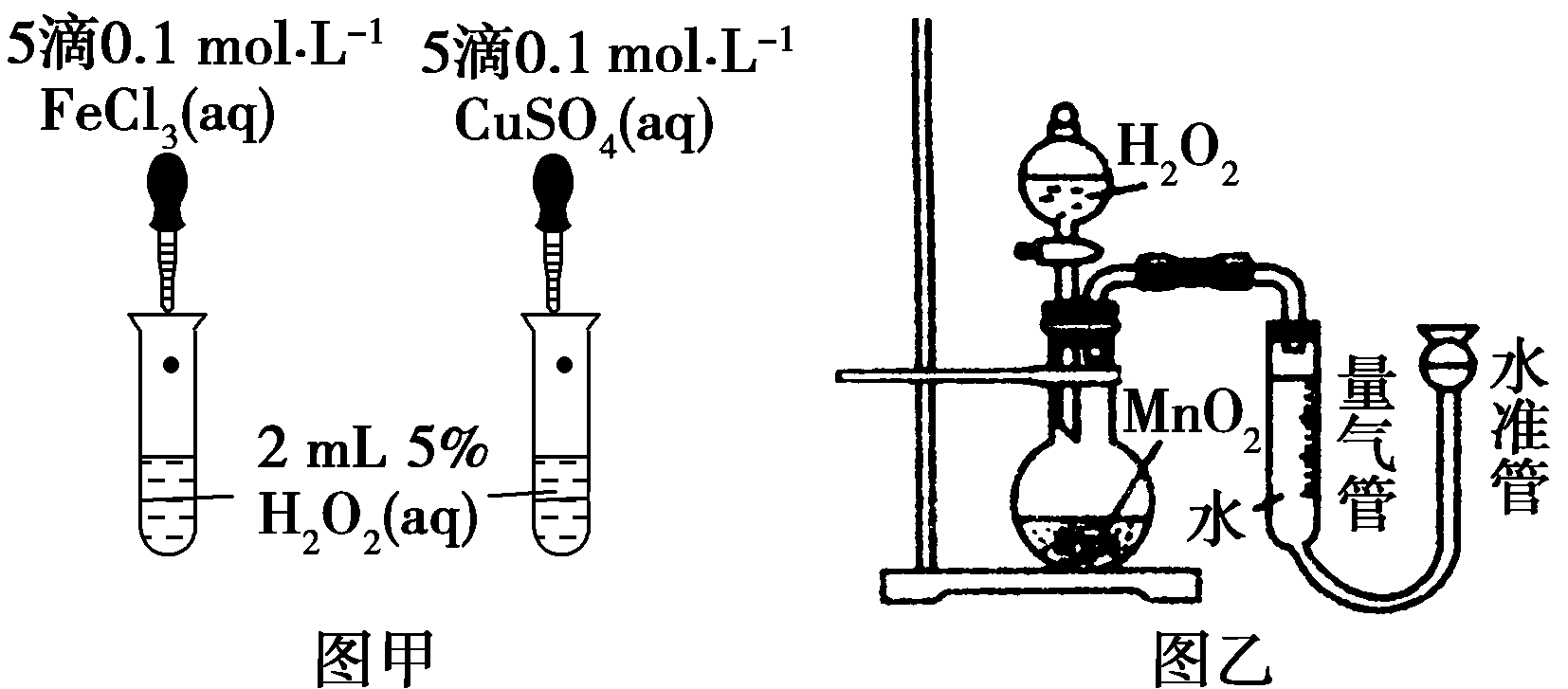
(1)同学X观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果,其结论________(填“合理”或“不合理”),理由是____________________________________。
(2)同学Y利用乙装置探究MnO2对H2O2分解的催化效果。将50 mL H2O2一次性加入盛有0.10 mol MnO2粉末的烧瓶中,测得标准状况下由量气管读出气体的体积[V(量气管)/mL]和时间(t/min)的关系如下图所示。
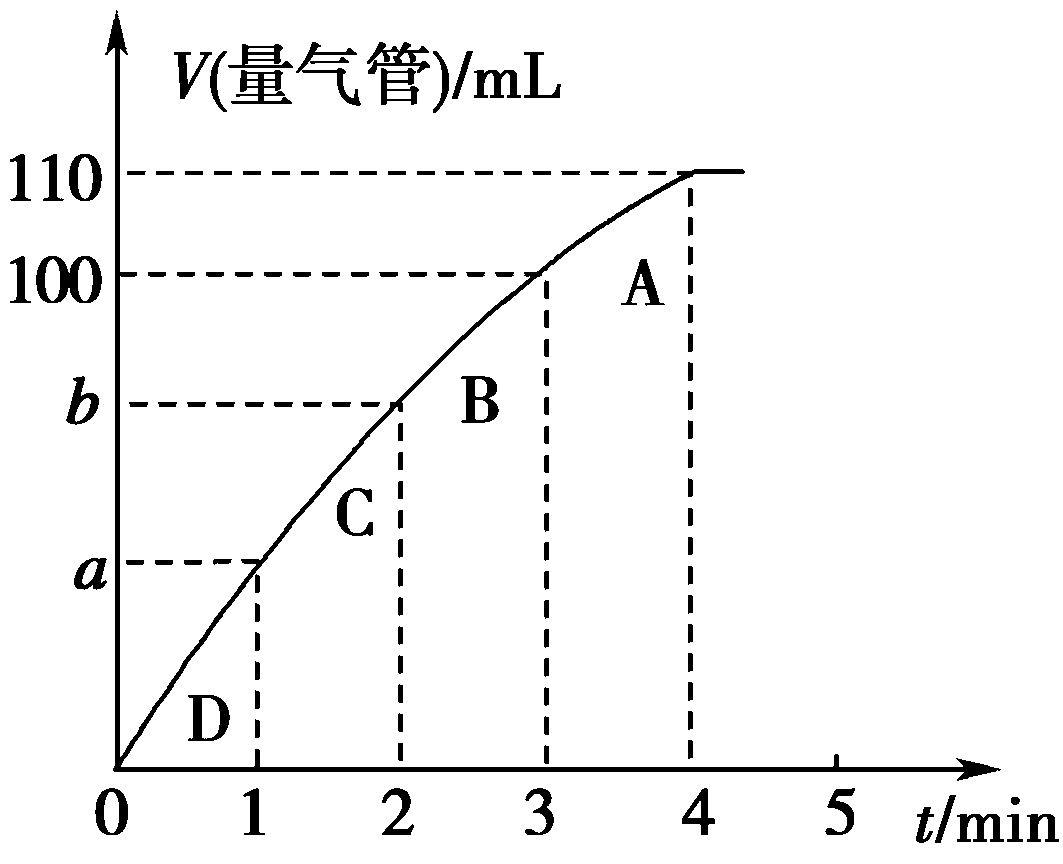
①实验时放出气体的总体积是________mL。
②b________(填 “大于”“小于”或“等于”)90 mL。
③同学Y除了探究MnO2对H2O2分解速率的影响情况,还可得出________对H2O2分解速率的影响情况。
解析:(1)甲实验中由于阴离子不同,所以不能说明反应速率的不同就是由阳离子影响的。 (2)由量气管读出气体的体积是烧瓶中加入的液体所排空气体积和反应生成氧气的体积之和,所以实验产生的气体体积等于110 mL-50 mL=60 mL;由于反应物浓度减小,反应速率减小,3~4 min生成10 mL气体,那么2~3 min生成气体的体积应大于10 mL,故b小于90 mL,反应物浓度减小,可以看出放出气体速率减小。
答案:(1)不合理 阴离子种类不同 (2)①60 ②小于 ③反应物浓度
18.(11分)钠是一种非常活泼的金属元素,其单质及化合物在科研、生产中起着重要作用。
(1)利用金属钠和CO2反应可制备金刚石,其相关反应的热化学方程式如下:
4Na(g)+3CO2(g)===2Na2CO3(l)+C(s,金刚石) ΔH=a kJ·mol-1
CO2(g)+4Na(g)===2Na2O(s)+C(s,金刚石) ΔH=b kJ·mol-1
反应6Na2O(s)+2C(s,金刚石)===8Na(g)+2Na2CO3(l)的ΔH=________kJ·mol-1(用含a、b的代数式表示)。
(2)T ℃时,体积为2 L的恒容容器中加入一定量的Na2SO4固体和氢气,发生如下反应:
Na2SO4(s)+4H2(g)Na2S(s)+4H2O(g)。
①若降低温度,K值减小,则反应的ΔH________0(填“>或“<”)。
②下列说法错误的是________。
A.增加Na2SO4(s)的量可加快反应速率
B.当混合气体的密度一定时,该反应达到平衡状态
C.保持温度不变,向平衡体系中再通入一定量的H2,平衡右移,但ΔH不变
D.其他条件不变,升高温度,则v(正)增大,v(逆)减小,平衡右移
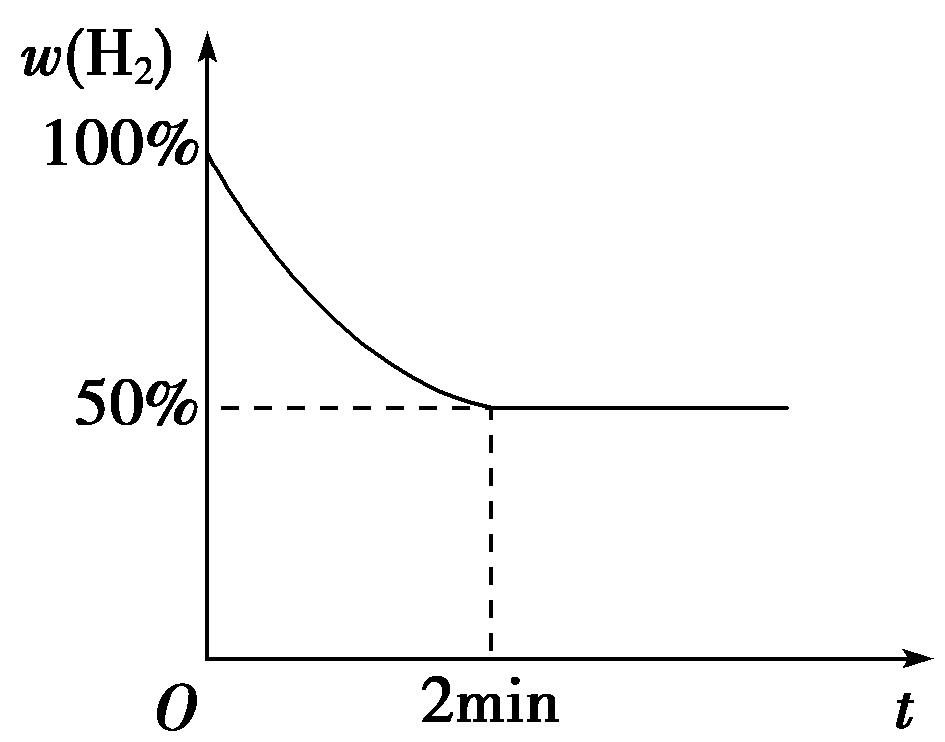
③若2 min内反应达到平衡,此时气体质量增加了8 g,则用H2表示的反应速率为________;已知反应过程中H2的体积分数与时间的关系如右图所示,则T ℃下该反应的平衡常数为________。
④若反应达平衡后,加入一定量的H2,再次平衡后H2O的体积分数________(填“增大”“减小”或“不变”)。
解析:(1)根据盖斯定律叠加方程式:前者—后者×3即得所求热化学方程式,据此计算反应热即可。(2)①降低温度,K值减小,说明平衡逆向移动,逆反应放热,正反应吸热,故ΔH>0。②固体量的增减不影响化学反应速率,A不正确;容器容积不变的情况下,反应正向进行,气体的质量增加,故密度增大;反应逆向进行,气体的质量减小,故密度减小,平衡时气体的质量不变,密度不变,B正确;向平衡体系中再通入一定量的H2,c(H2)增大,平衡右移,化学反应方程式确定,ΔH不因平衡移动而变化,C正确;升高温度,则v(正)、v(逆)均增大,D不正确。③气体质量每增加16 g,H2反应1 mol,故气体质量增加8 g时,H2反应0.5 mol,v(H2)= 0.125 mol·L-1·min-1,该反应的平衡常数K=c4(H2O)/c4(H2),由图象可知c(H2O)∶ c(H2)=1∶1,故K=1。④该反应温度未变,平衡常数不变,c(H2O)∶ c(H2)不变,故平衡后加一定量H2,再次平衡后H2O的体积分数不变。
答案:(1) a-3b (2)①> ②AD
③ 0.125 mol·L-1·min-1 1 ④不变
19.(12分)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4
kJ·mol-1,据此回答以下问题:
2NH3(g) ΔH=-92.4
kJ·mol-1,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K=________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越________。
(2)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K=________(可用分数表示)。能说明该反应达到化学平衡状态的是________(填字母)。
a.容器内的密度保持不变
b.容器内压强保持不变
c.v正(N2)=2v逆(NH3)
d.混合气体中c(NH3)不变
(3)对于合成氨反应而言,下列有关图象一定正确的是________(填序号)。
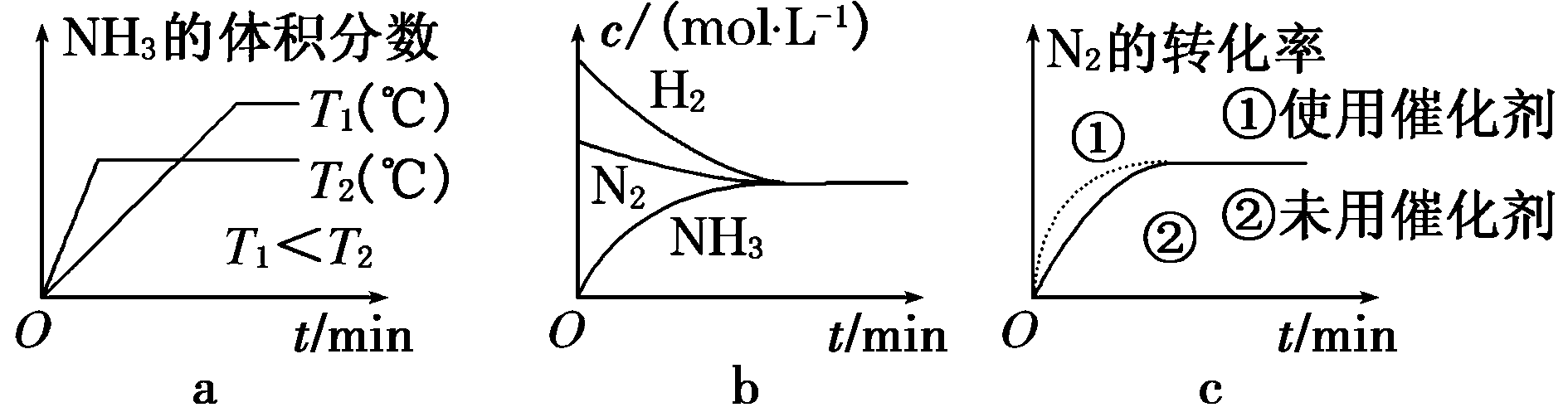
解析:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4
kJ·mol-1,是一个气体体积减小的放热反应。
2NH3(g) ΔH=-92.4
kJ·mol-1,是一个气体体积减小的放热反应。
(1)①由方程式知K=。
②升高温度,平衡向吸热反应方向移动,即向逆反应方向移动,c(NH3)减小,c(N2)、c(H2)增大,故减小,K值减小。
(2)设N2转化x mol·L-1,则
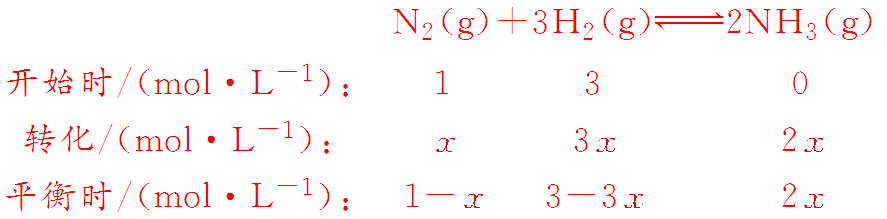
则×100%=20%,x=;K===。
判断平衡状态的标志是①v(正)=v(逆),②各成分的浓度保持不变。ρ=始终不变,a不能说明是否达平衡状态;=,c不能说明反应达平衡状态。
(3)温度越高,反应越快,达平衡所用时间越短。T1<T2,由T1→T2升高温度,平衡向逆反应方向移动,NH3的体积分数减小,a正确;达平衡时c(N2)、c(H2)、c(NH3)不变,不是c(N2)=c(NH3)=c(H2),b错误;使用催化剂,加快反应速率,但平衡不移动,c正确。
答案:(1)① ②小 (2) bd (3)ac
20.(12分)现有可逆反应:A(g)+2B(g)![]() C(g)+D(g) ΔH<0。在相同温度下,将1
mol A和2
mol B加入到容积固定不变的甲容器中,将2
mol C和2
mol D加入到容积可变的乙容器中,t1=5
min时两容器内均达到平衡状态,甲中c(C)=1.5
mol·L-1。请回答下列问题:
C(g)+D(g) ΔH<0。在相同温度下,将1
mol A和2
mol B加入到容积固定不变的甲容器中,将2
mol C和2
mol D加入到容积可变的乙容器中,t1=5
min时两容器内均达到平衡状态,甲中c(C)=1.5
mol·L-1。请回答下列问题:
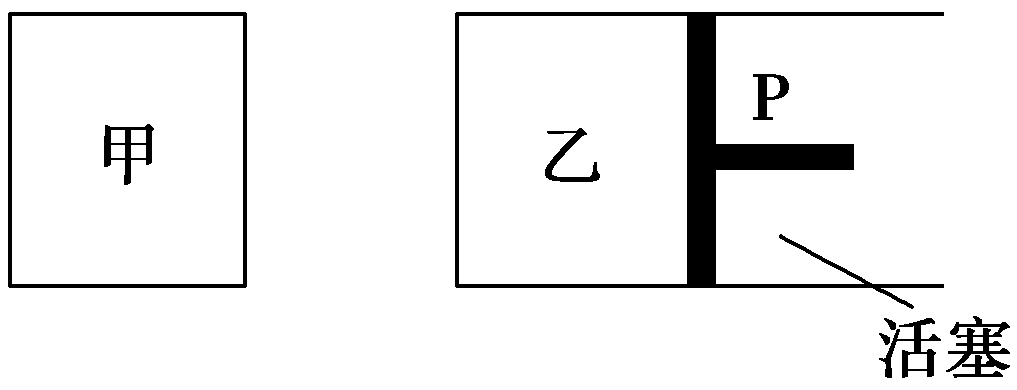
(1)5 min内,用B物质表示甲容器中的平均反应速率v(B)=________。
(2)若使甲容器化学平衡向正反应方向移动,则可以改变的条件是________(填字母);改变条件的瞬间,体系的正反应速率将________(填“增大”“减小”或“不变”)。
A.减小A的物质的量 B.降低体系的温度
C.增大D的浓度 D.加入催化剂
(3)保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙容器中C的物质的量浓度c(C)______3 mol·L-1(填“>”“<”或“=”)。
(4)保持温度不变,t2时分别向甲、乙中加入等质量的氦气后,下图中能表示甲中反应速率变化情况的是________,能表示乙中反应速率变化情况的是________。
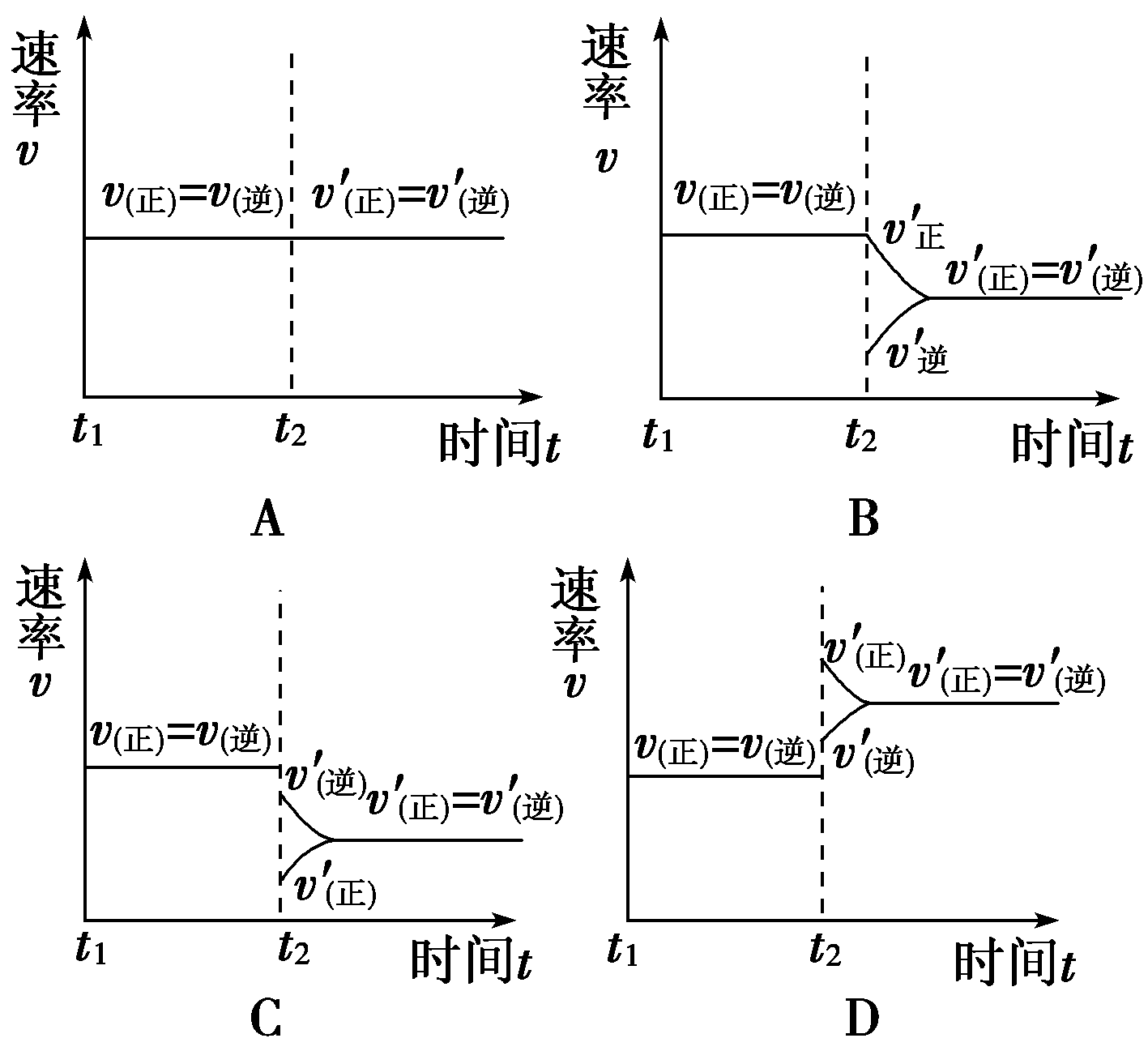
解析:(1)甲中达平衡时,c(C)=1.5
mol·L-1,则B的消耗浓度为3
mol·L-1,v(B)=3
mol·L-1/(5
min)=0.6
mol·L-1·min-1。(2)根据可逆反应:A(g)+2B(g)![]() C(g)+D(g) ΔH
<0。选项A,减小A的物质的量,降低了反应物的浓度,平衡向逆反应方向移动。选项B,降低体系温度,平衡向放热方向(正反应方向)移动。选项C,增大D的浓度,平衡向逆反应方向移动。选项D,加入催化剂平衡不移动。降低体系温度的一瞬间,正反应速率和逆反应速率都要减小。(3)保持温度不变,缩小乙容器的体积相当于加压,平衡向气体物质的量减小的方向(生成C的方向)移动,使C的物质的量增大,达新平衡时c(C)>3
mol·L-1。(4)在恒温恒容下加入He气体平衡不移动,图象A符合甲。在恒温恒压下加入He气体,平衡向气体物质的量增加的方向移动,由于浓度降低,正、逆反应速率比原平衡的小,选项C的图象符合。
C(g)+D(g) ΔH
<0。选项A,减小A的物质的量,降低了反应物的浓度,平衡向逆反应方向移动。选项B,降低体系温度,平衡向放热方向(正反应方向)移动。选项C,增大D的浓度,平衡向逆反应方向移动。选项D,加入催化剂平衡不移动。降低体系温度的一瞬间,正反应速率和逆反应速率都要减小。(3)保持温度不变,缩小乙容器的体积相当于加压,平衡向气体物质的量减小的方向(生成C的方向)移动,使C的物质的量增大,达新平衡时c(C)>3
mol·L-1。(4)在恒温恒容下加入He气体平衡不移动,图象A符合甲。在恒温恒压下加入He气体,平衡向气体物质的量增加的方向移动,由于浓度降低,正、逆反应速率比原平衡的小,选项C的图象符合。
答案:(1)0.6 mol·L-1·min-1 (2)B 减小 (3)>
(4)A C