第二章 分子结构与性质
第一节 共价键
第1课时 共价键
[目标要求] 1.掌握共价键的本质和特征。2.知道共价键的主要类型:σ键和π键。
![]()
共价键
1.概念:__________________________________叫共价键。
2.本质:____________________________________。
3.特点:
按共价键理论可知,一个原子只能与一定数目的原子结合形成分子,这说明共价键具有________性。在多原子的分子中键角一定,这说明共价键具有________性。
4.分类
(1)σ键
①形成:由成键原子的s原子轨道或p原子轨道“________”重叠而成。
②类型:形成σ键的能级可以是____与____、____与____、____与____。所以σ键分为三类,分别是________σ键、________σ键、________σ键。
③特征:以形成化学键的两原子核的________为轴做旋转操作,共价键电子云的图形________,这种特征称为__________。σ键的强度________。
(2)π键
①形成
由两个原子的p原子轨道“__________”重叠形成。
②价键轨道
含义:由原子轨道相互重叠形成的____________总称价键轨道,是分子结构的价键理论中最基本的组成部分。
③特征
π键的电子云具有____________性,即每个π键的电子云由两块组成,分别位于由
____________构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为
________。π键________旋转,一般不如σ键________,较易________。
5.判断是σ键或是π键的规律
共价________是σ键;共价________中一个是σ键,另一个是π键;共价________中
一个是σ键,另两个是π键。
![]()
1.写出下列分子的电子式:
(1)H2O2____________________
(2)NH3____________________
(3)H2____________________
(4)HCl____________________
(5)N2____________________
(6)C2H4____________________
(7)CO2____________________
2.下列说法正确的是( )
A.含有共价键的化合物一定是共价化合物
B.由共价键形成的分子一定是共价化合物
C.分子中只有共价键的化合物一定是共价化合物
D.只有非金属原子间才能形成共价键
3.关于σ键和π键的比较,下列说法不正确的是( )
A.σ键是轴对称的,π键是镜面对称的
B.σ键是“头碰头”式重叠,π键是“肩并肩”式重叠
C.σ键不能断裂,π键容易断裂
D.H原子只能形成σ键,O原子可以形成σ键和π键
4.下列物质的分子中,没有π键的是( )
A.CO2 B.N2
C.CH≡CH D.HClO
5.下列各分子中,所有原子都满足最外层为8电子结构的是( )
A.H2O B.BF3 C.CCl4 D.PCl5
![]()
![]() 练基础落实
练基础落实![]()
知识点1 共价键的存在和形成条件
1.下列各组物质中,所有化学键都是共价键的是( )
A.H2S和Na2O2 B.H2O2和CaF2
C.NH3和N2 D.HNO3和NaCl
2.从电负性的角度来判断下列元素之间易形成共价键的是( )
A.Na和Cl B.H和Cl C.K和F D.Ca和O
知识点2 共价键的类型和特征
3.下列有关σ键和π键的说法错误的是( )
A.含有π键的分子在反应时,π键是化学反应的积极参与者
B.当原子形成分子时,首先形成σ键,可能形成π键
C.有些原子在与其他原子形成分子时,只能形成σ键,不能形成π键
D.在分子中,化学键可能只有π键而没有σ键
4.下列说法正确的是( )
A.π键是由两个p原子轨道“头碰头”重叠形成
B.σ键是镜面对称,而π键是轴对称
C.乙烷分子中的键全为σ键而乙烯分子中含σ键和π键
D.H2分子中含σ键而Cl2分子中含π键
5.下列有关σ键的说法错误的是( )
A.如果电子云图象是由两个s电子重叠形成的,即形成 ss σ键
B.s电子与p电子形成sp σ键
C.p电子与p电子不能形成σ键
D.HCl分子里含一个sp σ键
知识点3 σ键、π键的判断
6.下列分子中含有两个π键的是( )
A.O2 B.N2 C.H2O D.C2H4
7.下列分子中,既含有σ键又含有π键的是( )
A.CH4 B.HCl C.CH2===CH2 D.F2
![]() 练方法技巧
练方法技巧![]()
共价键的表示方法
8.下列表示原子间形成共价键的化学用语正确的是( )
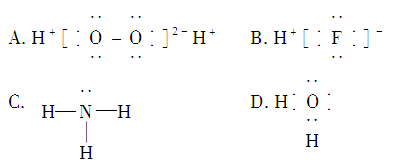
9.下列电子式书写错误的是( )

10.下列关于MgCl2的电子式书写正确的是( )

共价键特征的应用技巧
11.原子间形成分子时,决定各原子相互结合的数量关系的是( )
A.共价键的方向性 B.共价键的饱和性
C.共价键原子的大小 D.共价键的稳定性
化学键类型与作用力强弱的判断技巧
12.只有在化合物中才能存在的化学键是( )
①离子键 ②共价键 ③极性键 ④非极性键
A.①② B.②③ C.①③ D.②④
13.下列说法中正确的是( )
A.共价化合物中可能含有离子键
B.非金属元素之间不能形成离子键
C.气体分子单质中一定存在非极性共价键
D.离子化合物中可能含有共价键
14.对比以下几个反应式:Cl+Cl―→Cl2 ΔH1=-247 kJ·mol-1;
O+O―→O2 ΔH2=-493 kJ·mol-1;
N+N―→N2 ΔH3=-946 kJ·mol-1。
可以得出的结论是( )
A.在常温下氮气比氧气和氯气稳定
B.氮、氧和氯的单质常温下为气体
C.氮、氧和氯都是双原子分子
D.氮气、氧气和氯气的密度不同
![]() 练综合拓展
练综合拓展![]()
15.下列不属于共价键成键因素的是( )
A.共用电子对在两原子核之间的高概率出现
B.共用的电子必须配对
C.成键后的体系能量降低,趋于稳定
D.两原子核体积大小要适中
16.某有机物的结构如下:
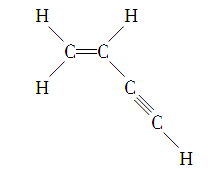
则分子中有________个σ键,________个π键。
17.有A、B、C、D四种元素。已知:①它们均为周期表中前20号元素,C、D在同一周期,A、B在同一主族;②它们可以组成化合物B2C2、A2C、DC2等;③B的阳离子与C的阴离子的核外电子排布相同;④B2C2同A2C或DC2反应都生成气体C2,B与A2C反应产生气体A2,A2与气体C2按体积比2∶1混合后点燃能发生爆炸,其产物是一种无色无味的液体(在常温下)。请回答下列问题:
(1)写出A、B、C、D四种元素的元素符号:
A________、B________、C________、D________。
(2)在B2C2、A2C和DC2中,属于离子化合物的是________,其电子式是___________,属于共价化合物的是____________________,其结构式是_____________________。
第二章 分子结构与性质
第一节 共价键
第1课时 共价键
基础落实
1.原子间通过共用电子对形成的化学键
2.共用电子对对两原子的电性作用
3.饱和 方向
4.(1)①头碰头 ②s s s p p p s-s s-p
p-p ③连线 不变 轴对称 较大 (2)①肩并肩 ②σ键和π键 ③镜面对称 两原子核 镜像
不能 牢固 断裂
5.单键 双键 三键
课堂练习
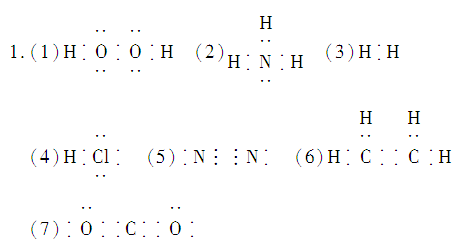
2.C [在离子化合物中也有共价键,如NaOH;由不同元素的原子形成的共价键分子是共价化合物,由相同元素的原子形成的共价键分子是单质,如H2、Cl2等;对于D项,也存在金属元素的原子与非金属元素的原子间形成共价键的化合物,如AlCl3等。]
3.C [σ键较稳定,不易断裂,而不是不能断裂。化学反应的实质是:旧键的断裂和新键的形成。]
4.D 5.C
课时作业
1.C [A项,Na2O2中既有离子键又有O-O共价键,不正确;B项,CaF2中只有离子键,不正确;D项,NaCl属于离子化合物,没有共价键。]
2.B [本题主要考查共价键的形成条件,非金属原子之间易形成共价键,活泼的金属原子和活泼的非金属原子之间易形成离子键。结合电负性与元素的性质之间的关系,我们可以得到元素的电负性差值越大,越易形成离子键;差值越小,越易形成共价键。]
3.D [本题主要考查σ键和π键的形成。由于π键的键能小于σ键的键能,所以反应时易断裂,A项正确;在分子形成时为了使其能量最低,必然首先形成σ键,根据形成的原子的核外电子排布来判断是否形成π键,所以B项正确;像H原子跟Cl原子只能形成σ键,所以C项正确。]
4.C 5.C 6.B 7.C
8.D [H2O2、HF都为共价化合物,其正确的电子式应不带“[]”,无阴、阳离子。NH3为共价化合物,结构式中未共用的孤电子对不写在元素符号的周围。]
9.D [BF3为共价化合物,其正确的电子式应不带“[]”,无离子。]
10.C [MgCl2属于离子化合物,在书写时各离子要标明所带电荷的情况,故A项错误;化合物电子式中相同部分不可合并,故B项错误;标明阴离子及原子团带电情况时应用“[]”,故C项正确。]
11.B
12.C [由离子键、极性键的定义及形成条件可知这两种键型只存在于化合物中,单质分子内可形成共价键、非极性键(如H2、Cl2中的H—H、Cl—Cl),故①、③正确。]
13.D [只含有共价键的化合物是共价化合物,故A错;铵盐(如NH4Cl、NH4NO3)是非金属元素间形成的离子键,故B错;C项应注意稀有气体单质分子内不存在化学键。]
14.A [原子结合成分子时释放的能量越多,表示形成的共价键越牢固,含有该键的分子越稳定,分子的稳定性与物质的物理性质无关,故A正确。]
15.D [共价键形成时,成键原子通过形成共用电子对为两原子核吸引,体系能量降低。参与成键的原子轨道重叠越多,电子对在核间出现概率越多。]
16.7 3
解析 除5条单键全是σ键外,双键中1个是σ键,另1个是π键,三键中1个是σ键,另2个是π键。故该有机物分子中σ键总数为7,π键总数为3。
17.
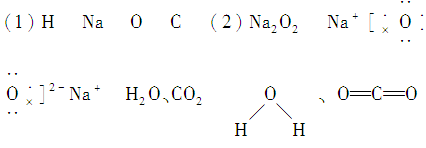
解析 本题的解题突破口为B2C2,可联想为H2O2、Na2O2、C2H2等。再根据B的阳离子与C的阴离子的核外电子排布相同可确定B为钠、C为氧,气体C2即为氧气。由④又可推测A2C为水,DC2为二氧化碳,Na与H2O反应生成H2,H2与O2按体积比2∶1混合能发生爆炸,这样A为氢,D为碳。其他依次推出。